現在、生物化学、シーケンシング(DNA の塩基配列決定)・ハードウェアおよび人工知能( AI )による斬新なアプローチによって、腫瘍学が融合し、変革を遂げつつあります。例えば、近い将来臨床医は、簡単な非侵襲(体に障害・負担を与えない)採血だけで様々な形態のがんを早期発見することができるようになるかもしれません。本レポートでは、がんが人体の中でどのように出現し、進行するか、そして様々な技術によりいかにしてがんのシグナルが検出されているかに焦点を当てていきます。前回の「がん発見の早期化」シリーズのレポートと同様、当社のモデルを一般公開し、コミュニティーからのフィードバックを取り入れてより包括的なホワイトペーパーに反映させることを目指しています。
がんは遺伝子疾患である
次世代型DNA シーケンシンサー( NGS )のコストが大幅に低下 したことにより、腫瘍生物学の解明が加速的に進んでいます。固形腫瘍は、 体細胞進化 と呼ばれる過程を経て、ランダムなペースで進行します。この過程は、時間とともに細胞内に蓄積した遺伝子変異がどのように腫瘍へと発達するかを示すものです。人体のほぼすべての細胞に宿る遺伝性変異とは異なり、体細胞の突然変異は 自然発症 し、腫瘍を生じさせます。危険な体細胞変異は極めて稀ではあるものの、細胞分裂におけるエラーや DNA 修復におけるミス、発がん性物質への曝露に
よって起こります。
固形腫瘍は遺伝子の組み換えられた細胞が密集した集団です。すべての集団は、犬猫であれがん細胞であれ、 自然淘汰 の法則に支配されます。 がん細胞 変異と呼ばれる一部の体細胞変異は、がん細胞に健康な細胞を打ち負かす進化上の優位性をもたらします。細胞分裂の調整を司る遺伝子が一度変異すると、がん細胞集団は急速かつ無制御的に増殖します。
幸いなことに、NGS やバイオインフォマティクス(生命情報科学)、合成生物学、データ・プロセッシング(必要とする回答・結果を得るためにコンピューターを使って行なうデータ処理)などのイノベーション(技術革新)により、がんに関する私たちの理解は広がっています。また、 シングルセル・シーケンシング (細胞 1 個単位での遺伝子発現を直接測定する技術)や ロングリード・シーケンシング (長く断片化された DNA 塩基配列の解析で、短い断片を用いた解析よりも正確性が向上する)、オプティカル・マッピング (蛍光標識を用いる DNA 塩基配列解読手法)、デジタル空間プロファイリング (遺伝子発現を高解像度で空間的に解析する技術)といったより新しいゲノム分野も、腫瘍生物学の解明を促進しています。 ARKでは、過去 20 年間に構築された知識の基盤によって、臨床医ががんをより早期に発見し、より有効に治療できるようになるとみています。
がんのアキレス腱(弱点)となる無細胞DNA には課題がある
未知の生物学は危険性を伴いますが、同時に科学者にがんを早期発見する機会を与えてくれます。がん細胞は、その増殖・分裂・死滅の過程で、 遺伝物質 の破片を血中に放出します。血中循環腫瘍 DNA (ctDNA )と呼ばれるこの破片の一部には、その腫瘍の原因であったりその腫瘍に関連する遺伝子変化が含まれています。しかし残念ながら、健康な細胞も無細胞 DNA (cfDNA )と呼ばれるDNA を血中に放出しているのです。血液検査でおびただしい数の健康な cfDNAの中から希少な変異 ctDNA を見つけることは、ノイズのなかでシグナルを見極めることであり、がんの早期発見における主要な技術的課題となっています。
バックグラウンドcfDNA に対するがん関連 ctDNA の割合は 変異アレル頻度(VAF )または腫瘍比と呼ばれ、がんの早期発見に伴う「干し草の山から針 1 本」(見つけるのが困難であることの例え)問題を定量化するものです。 VAF は体内の腫瘍の大きさに 正比例 し、初期の腫瘍のなかには VAF が 1 万分の 1 0.01まで低いものもあります(下図参照)。

出所:ARK Investment Management LLC (2021 年)
次のセクションでは、リキッドバイオプシー(液性検体を使って診断や治療効果予測を行なう技術)によって主要な VAF 課題が克服されつつある様子を説明します。重要な点として、 NGS や人工知能( AI )、合成生物学(生物の構成要素を組み合わせて生命機能を人工的に設計したり人工の生物システムを構築したりする学問分野)といったテクノロジー・プラットフォームが飛躍的に向上したことにより、リキッドバイオプシーの高性能化とがんスクリーニング検査向けの商用化が可能になっていることです。
I. 体細胞 DNA の突然変異
がん遺伝子(変異するとがんになる可能性のある遺伝子)の体細胞 DNA 変異は、腫瘍が形成されつつあることを示す最も信頼度の高いシグナルであると考えられます。発がん性のあるヒト遺伝子はまだ 発見過程 の半ばにありますが、その割合は、 ヒト遺伝子全体の約 1~2% 程度にすぎないようです。しかし、このような低いVAF での体細胞変異の検出は、エラーが起こりやすい上に桁違いのコストがかかるものでした。
検体を準備する過程で、検査技師はがん細胞を分析用に複製するのにポリメラーゼ連鎖反応( PCR) と呼ばれる手法をよく用います。 PCR は体細胞変異のシグナルを増幅しますが、完璧なわけではなく、各サイクルにおいて実際の変異のように見える ミスが生じ得ます 。制御されていないこれらの PCR アーティファクト(処理過程で生じる副産物)のために、偽陽性の結果が出る場合があります。この課題を、 Guardant Health 社や Invitae 社、 Natera 社、 Exact Sciences 社などの多くの企業が合成生物学と AI を用いて 克服 しています。
合成生物学は生物学的製造の振興分野で、そのコストが低下するとともに製造単位の規模が急速に拡大しています。合成生物学により、リキッドバイオプシーに注力する企業は、非常に入念に設計された 分子バーコード を用いて PCR のエラーを修正することが可能となります(下図参照)。これらのバーコードは、シーケンシングの過程でずっと元の DNA 分子に付着してその後を追います。同じバーコードを持つ DNA の破片を比較することにより、バイオインフォマティクス技術者は自然発生した PCR アーティファクトから真の変異を区別することができます。残念ながら、このようなエラー修正方法には、多くの 冗長なシーケンシング が必要となるため、リキッドバイオプシーのシーケンシング作業負荷が劇的に増加する可能性があります。
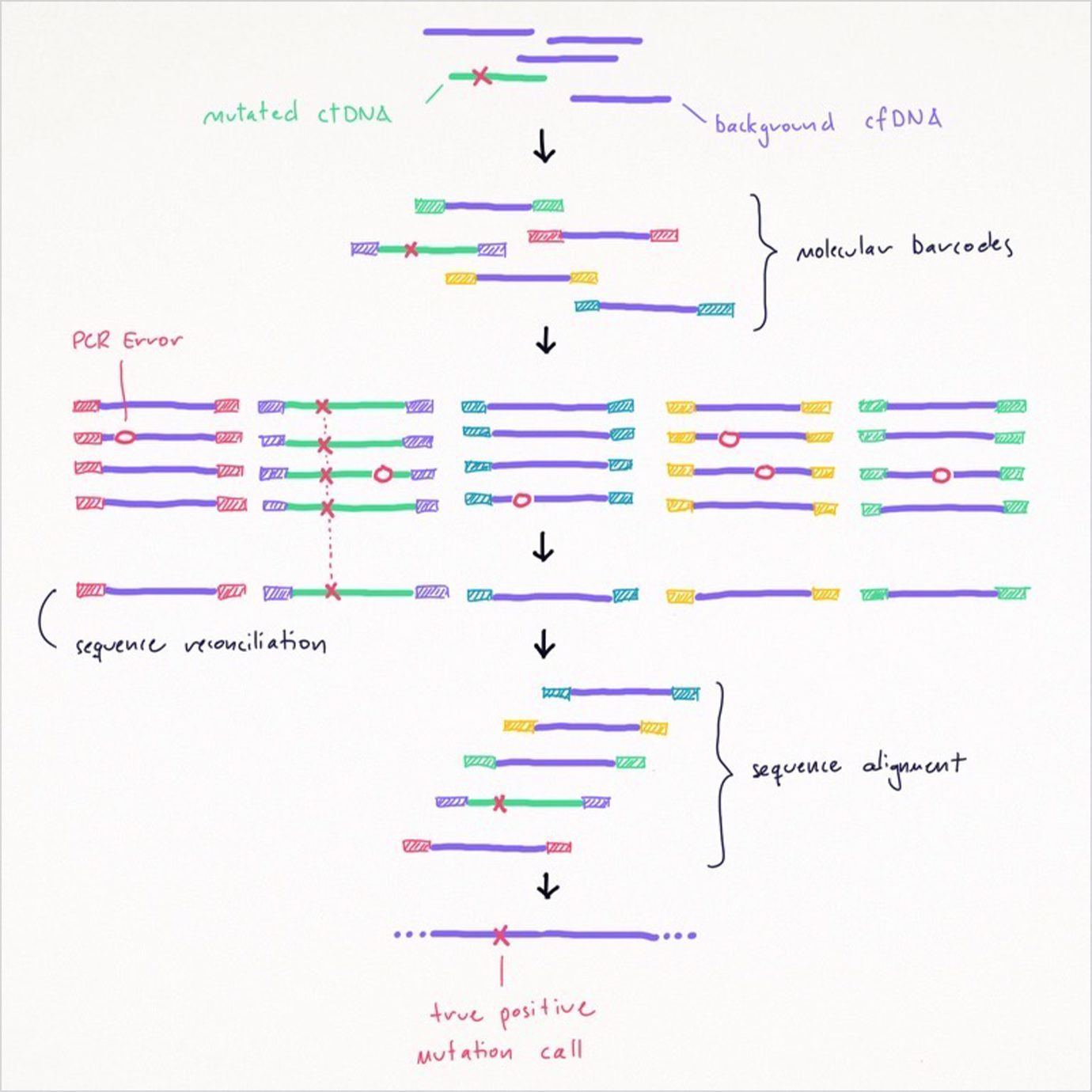
出所:ARK Investment Management LLC (2021 年)
希少な変異を確実に検出するには、極めて深いシーケンシングが必要となります。シーケンシングの深さの測定には「 カバレッジ 」が用いられますが、これはざっくり言うとシーケンサー(シーケンシングを行なう装置)が DNA 塩基を読み取る回数のことです。参考までに、研究者は 平均で 30 倍のカバレッジ でヒトゲノム全体のシーケンシングを行なっています。シーケンシング 1 回当たりのコストはカバレッジに正比例します。重要なことは、 VAF とシーケンス・カバレッジとの関係は直線的ではなく指数関数的であるということです。エラー修正は、すでに高いシーケンシングのコストを 5 倍から 10 倍 も膨らませることになりかねません。しかし、 NGS の急速なコスト低下とスケーラブル(規模の拡大に対応可能)で効率性の高い合成生物学ソリューションのおかげで、エラーの発見や超低水準 VAF での変異の修正が大幅に低いコストで行なえるようになってきました。
II.メチル化と機械学習( ML)
体細胞DNA の変異は、しばしばがんの最も得意的な指標とみなされていますが、患者の血液検体に AI を大規模に適用することによって、これの代替となるシグナルを得ることができます。例えば、がん検査技術開発企業の GRAIL 社などによる最近の研究では、機械学習を用いて DNA のメチル化 を表面化させ、 DNA 変異のみの場合よりも早期にがんを検出することに成功しています。
DNAのメチル化とは、 DNA の外側にある化学修飾(たんぱく質や DNA などの生体高分子に含まれる特定の官能基を化学的に変化させて活性や反応性などの機能を変化させること)を指します(下図参照)。細胞の遺伝子を本に例えると、体細胞の突然変異はスペルミスのようなもので、メチル化は単語の正しいスペルを太字やイタリック体で提示するといった感じです。メチル化は、細胞が DNA の指示をどのように読み、どのように反応し、どのように表現するかを変えることができます。ヒト遺伝子では、メチル化は 4 つの DNA 塩基のうちシトシン C 1 つのみに影響を与え、 2,800 万ヵ所の CpG サイト(シトシンの次にグアニンが現れるタイプの2 塩基配列)に 集まっています 。
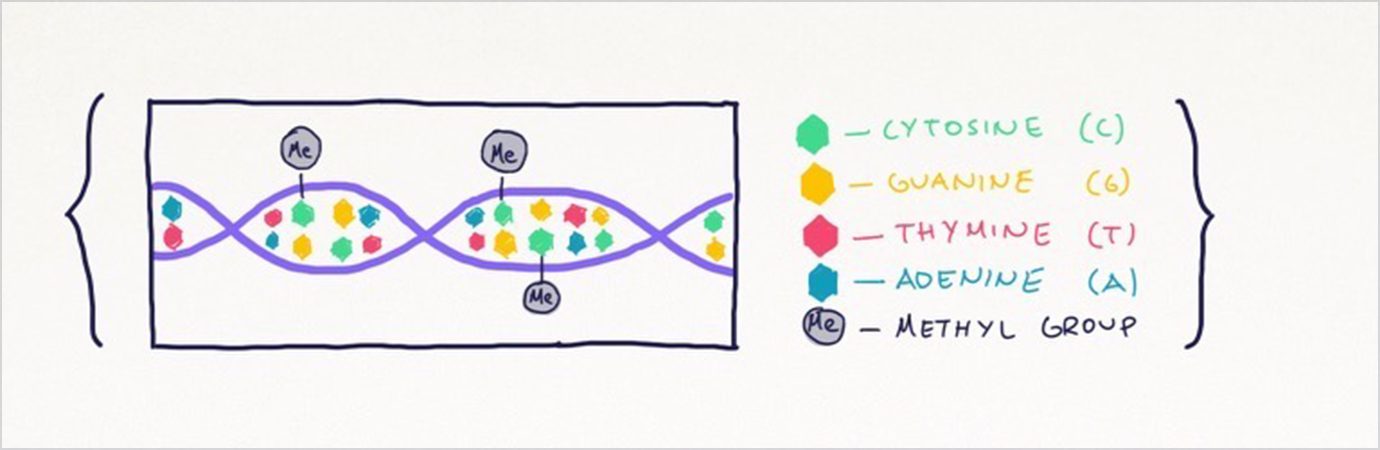
出所:ARK Investment Management LLC (2021 年)
サイモン・バーネットによるイラスト
GRAIL社は数千人もの患者の血液検体を用いて偏りのない機械学習を展開し、様々ながんに関係する 10 万ヵ所の CpG サイトを特定しました。メチル化がどのようにしてがんを引き起こしたり、加速させたりするのかは正確には把握されていないため、腫瘍との関係は因果関係というよりも相互作用するものであると言えます。結果として、単一のメチル化部位の予測力は、発がん性のある体細胞 DNAの突然変異に比べて低くなりますが、数千もの部位に広がる集合的なメチル化の痕跡を合わせると、がんの存在を予測する強力な因子となります。
当社のリサーチが示すところでは、機械学習によってメチル化ベースのリキッドバイオプシーはそのコストが劇的に低下しており、商用化に大きく近づいています。メチル化部位がふんだんにあることから、異常にメチル化された腫瘍 DNA を検出するのに極端に高いカバレッジは必要ありません。ニューラル・ネットワーク(脳の神経回路を模した数理モデル)はデータ量やモデルの規模、コンピューター計算の拡大に伴って向上するため、メチル化を含むリキッドバイオプシーの正確性および費用対効果は時とともに増すとみられます。
がん発見の早期化という恩恵をもたらす一方で、DNA のメチル化は合成生物学が登場するまでは血液検体から発見するのが困難でした。標準的な DNA シーケンシングとは異なり、メチル化のシーケンシングには追加の検体調製が必要となります。検査技師は多くの場合、バイサルファイト処理( DNA を亜硫酸水素塩で処理し構成塩基を化学修飾する方法)や酵素を用いて、メチル化していないシトシン( C )塩基をチミン塩基に 変換 し、メチル化したシトシン( C )塩基はそのままにしておきます。そうすると、下流のアルゴリズムにより、元の検体内でメチル化したシトシン( Cs )を特定することができるようになります。このプロセスは複雑さを増すため、シーケンサーが解読の焦点を遺伝子の正しい領域に当てるのを妨げる可能性があります(下図参照)。いわゆる「 オフターゲット 」シーケンシング(ターゲットとしない領域のシーケンシング)は検査結果には何も貢献せず、業務コストと損失時間が増すことになるだけです。
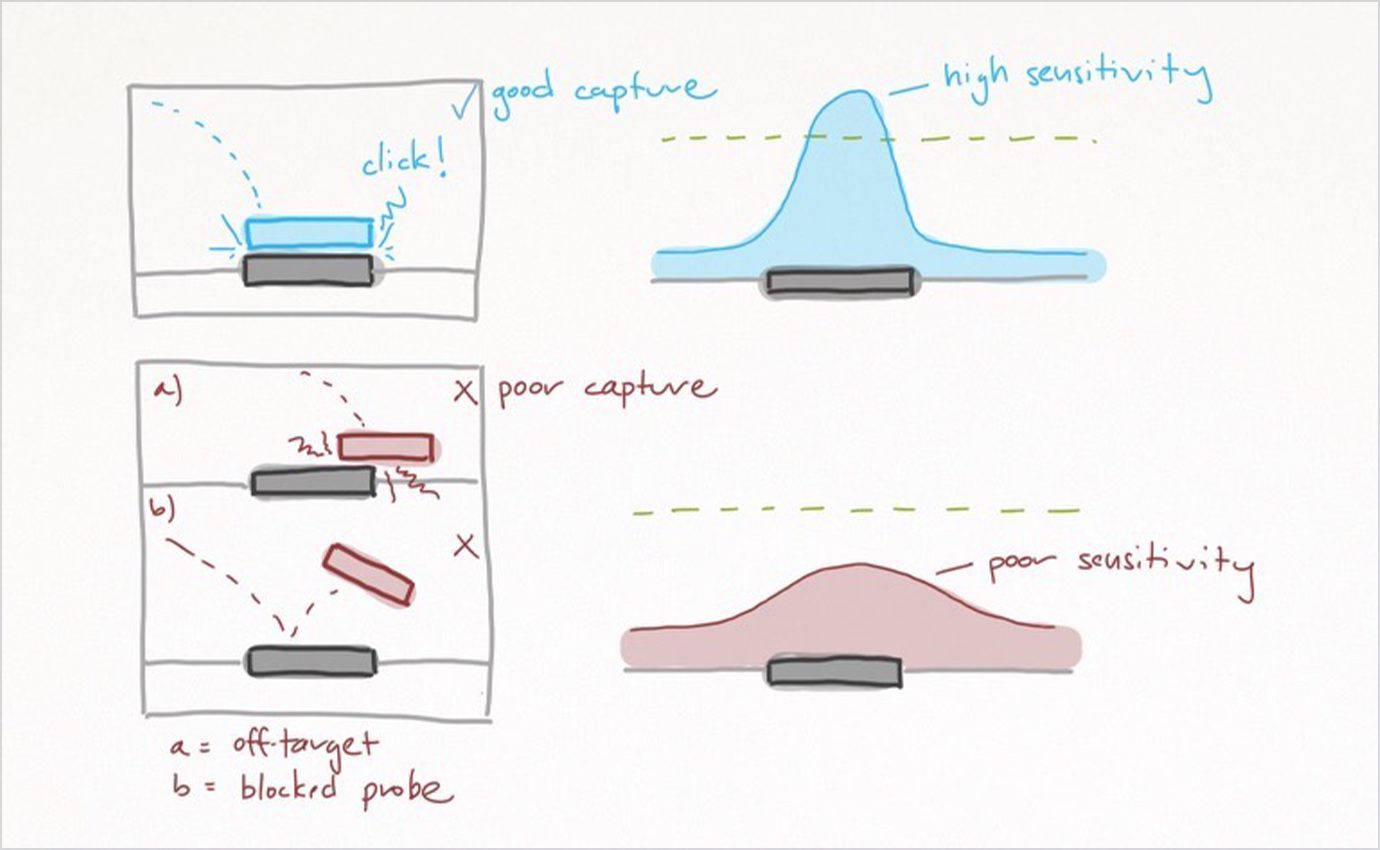
出所:ARK Investment Management LLC (2021 年)
この課題に製造およびデータサイエンス(データを用いて科学的・社会的に有益な新たなる知見を引き出そうとするアプローチ)における自社の専門性を活かして取り組んでいるのが、合成生物学のリーディング企業である Twist Biosciences 社です。同社が設計した メチル化専用のキャプチャープローブ (特定の遺伝子領域をターゲットとしそれに結合する小分子)によって、シーケンシングの焦点を適切な領域に集中させることに成功しました(下図参照)。同社の均一性の高いキャプチャープローブは、 GRAIL 社の早期発見技術を可能にしています。 Twist Biosciences 社の製品は低コストで正確性が高くカスタマイズできることから、同社はメチル化研究へのアクセスを一般化してがんスクリーニングにおけるリキッドバイオプシーの利用を促進する可能性があると当社では考えています。加えて、最近 Exact Sciences 社 が買収した非公開企業 Base Genomicsは、エピゲノム( DNA の塩基配列に加えられた化学修飾)の情報を保存し、メチル化のようなバイオマーカー(疾患の有無や進行状態を示す目安となる生体内物質)をコスト効率的に正確に発見する、侵襲性のより低い 検体調製アプローチを開発しています。
III. 機械学習によるマルチオミックスモデルの実現
がんのシグナルは体細胞DNA の突然変異やメチル化にとどまりません。マルチオミックスとは、フラグメントミクス( cfDNA がどのように分解されるかの研究)やプロテオミクス(血流中に循環するたんぱく質の研究)、トランスクリプトミクス(遺伝子発現の変化 の仕方に 関する研究)など複数の研究分野のデータセットを組み合わせることです(次ページ図参照)。また、いくつかの研究グループは、がんのマーカーとして、 5hmC (5 ヒドロキシメチルシトシン)のような新しい「フレーバー」やネオマー と呼ばれる非天然型 DNA の短い断片をがんのマーカーとして指名しています。
Freenome社 のような企業は、そのようなシグナルをいくつか取り入れたマルチ検体型やマルチオミックス型の機械学習モデルを他に先駆けて開発しています。重要な点として、前述した多くの研究分野のシグナルは直交的または相加的で、生物学的ノイズを低減するがんのシグナルを生み出していることが挙げられます。当社では、マルチオミックスを実現する上で重要なのは、 AI モデル・トレーニングにかかるコストが大幅に削減されたことであると考えています。
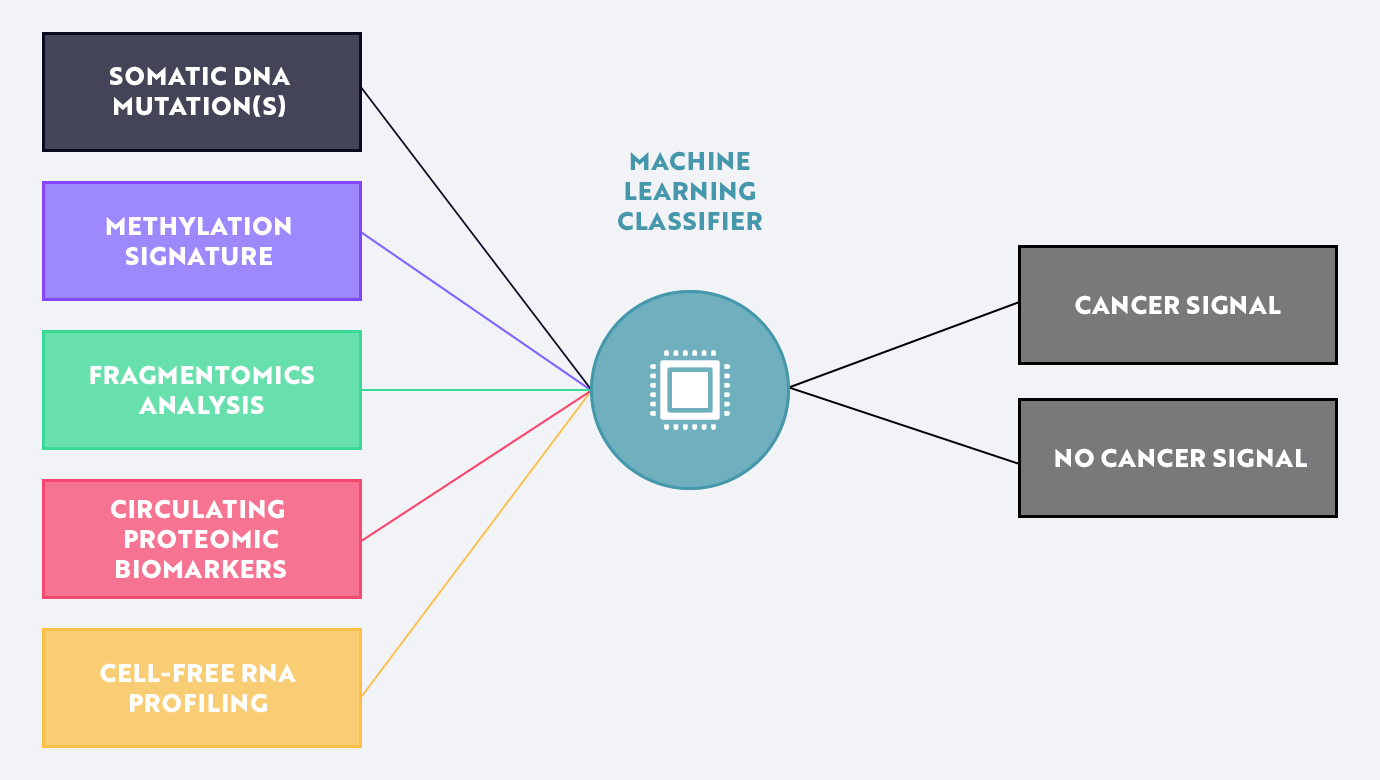
出所:ARK Investment Management LLC (2021 年)
まとめ
当社では、次世代型DNA シーケンシング( NGS )や人工知能 AI )、合成生物学などかつては別々に存在していたテクノロジー・プラットフォームの融合により、検査メーカーが初期がんの存在を非侵襲血液検査で検出できるようになってきたとみています。こうした技術の間の境界線はなくなってきており、これらの研究分野を超えた自発的なイノベーションと協力が求められています。したがって、研究開発に積極的に投資しない企業は、新しい世界で足場を失うことになるでしょう。
NGSや AI 、合成生物学のもたらす飛躍的なコストの低下によって、リキッドバイオプシーをがんの発見に適用することが可能となりつつあります。そのようなコスト低下のテンプレートとなっているのが、ムーアの法則( Intel 創業者の 1 人であるゴードン・ムーアが唱えた「半導体の集積率は 18 ヵ月で 2 倍になる」という経験則)における時間を生産量に置き換えたライトの法則です。ライトの法則によると、生産量の拡大によってコストの低下が続くことから、リキッドバイオプシーはその実行可能性と精度が向上するとみられます。
ARK's statements are not an endorsement of any company or a recommendation to buy, sell or hold any security. For a list of all purchases and sales made by ARK for client accounts during the past year that could be considered by the SEC as recommendations, click here. It should not be assumed that recommendations made in the future will be profitable or will equal the performance of the securities in this list. For full disclosures, click here.


